[摘 要]
随着胸部低剂量 CT 的普及,磨玻璃结节(ground-glass opacity,GGO)的检出率逐年升高。影像学表现为 GGO 的肺部病变病理上可能是良性病变,但持续存在的 GGO 多提示早期肺癌。GGO 型肺癌和传统肺癌不同,常见于年轻、女性和不吸烟人群,具有惰性生长的特点,外科处理窗口期长,GGO 是部分传统肺癌的早期表现。
GGO 型肺癌目前在筛查、病理、手术及术后随访等方面缺乏共识,本文综述了 GGO 型肺癌的个体化全程管理策略。GGO 型肺癌的筛查应该遵循“低龄、低频”的策略。原位腺癌、微浸润腺癌、贴壁亚型和非贴壁亚型肺腺癌在影像学上均能表现为 GGO。
GGO 型肺癌的手术治疗需遵循以下策略:避免将良性病变当恶性肿瘤治疗,避免将早期肿瘤当进展期肿瘤治疗,避免将惰性肿瘤当快速进展肿瘤治疗,可选择不影响人生轨迹和职业生涯的时机进行手术。GGO 型肺癌患者术前不需行气管镜和骨扫描检查。对于部分 GGO 型肺腺癌,亚肺叶切除便能达到根治效果,且无需进行纵隔淋巴结清扫。术中冰冻病理检查能够指导 GGO 型肺癌的手术方式。鉴于 GGO 型肺癌具有良好的预后,这部分患者可以采取更加宽松的术后随访策略。
关键词: 磨玻璃结节;病理;预后;手术切除;筛查
[正 文]
近年来,随着胸部低剂量计算机断层扫描(low-dose computed tomography,LDCT)的应用,肺癌筛查的普及率逐年上升。在中国,LDCT 具有价格低、可及性强等特点,传统的高龄、吸烟等“肺癌高危人群”和不具备以上高危因素的普通人群都可接受 LDCT 肺癌筛查。其中,一类 CT 表现为磨玻璃结节(ground-glass opacity,GGO)的病变被发现,引起了广泛关注。在西方人群中,NELSON 筛查研究发现 GGO 存在于 3.3% 的参与者中。在亚洲人群中,一项韩国的筛查研究表明 2.7% 的参与者存在 GGO 病变。虽然 GGO 是一种非特异的影像学特征,但是持续存在的 GGO 往往提示早期肺癌。一项中国的研究发现,接受 LDCT 肺癌筛查的人群中,2.0% 患有 GGO 型肺腺癌。GGO 型肺癌是一类“惰性”的肺部恶性肿瘤,外科处理的窗口期较长,是部分传统肺癌的早期表现。其诊治方法有别于传统肺癌。
本综述总结了 GGO 的影像学定义及分类、病理学、自然病程,并探讨 GGO 型肺癌的筛查策略、手术指征及术后随访,提出一套 GGO 型肺癌的个体化全程管理策略,为 GGO 型肺癌的规范化诊治提供依据。
一、GGO 的定义及分类
1989 年,Gamsu 等首次报道在肺部高分辨率 CT 上表现为磨玻璃密度增高影的病变,提示肺部处于炎症活动期。1993 年,Remy-Jardin 等首次系统地定义了 GGO,其必须符合以下 4 个标准:
密度增高的磨玻璃影;
没有遮挡住其下的肺血管和肺支气管;
必须为高分辨率 CT 的影像学结果;
有较宽的窗宽设置(窗宽:1 500~2 000 Hu,窗位:500~700 Hu)。
早期研究一直认为 GGO 是肺部炎症的一种影像学表现,直到 1996 年才有学者提出,GGO 也可能为早期肺腺癌。根据 Fleischner 学会的定义,GGO 是一种表现为磨玻璃密度增高影且同时能够显现出其下肺血管和肺支气管影的影像学特征。
目前,通常根据 CT 肺窗上是否存在实性成分,将 GGO 分为纯 GGO(pure GGO,pGGO)和混合 GGO(mixed GGO,mGGO)。仅有 GGO 成分而没有实性成分的肺结节被定义为纯 GGO,而同时含有 GGO 成分和实性成分的为混合 GGO。根据 CT 纵隔窗上是否可见上述实性成分,可进一步将混合 GGO 分为异质性 GGO(heterogeneous GGO,hGGO)和“真”混合 GGO。纵隔窗上实性成分不可见的称为异质性 GGO;在纵隔窗上可见实性成分的称为“真”混合 GGO。
二、GGO 的病理学
GGO 是一种非特异的影像学表现,病理上可对应多种病变,例如局灶纤维化、出血、炎症等良性病变以及包括原位腺癌(adenocarcinoma in situ,AIS)、微浸润腺癌(minimally invasive adenocarcinoma,MIA)及浸润性腺癌(invasive adenocarcinoma,IAC)在内的恶性病变。在临床工作中,应提高 GGO 型病变的诊断准确率,尽量避免对表现为 GGO 的良性病变进行手术。然而,如何能有效地辨别 GGO 的良恶性,是胸外科医师所面临的挑战。
GGO 型肺癌均为肺腺癌。Engeler 等认为影像学上表现为 GGO 的区域,其本质是保留完整肺泡结构的肺泡壁增厚。因此,理论上影像学中的 GGO 成分应该对应病理学中肺腺癌贴壁生长(lepidic growth pattern)的成分。然而,有时情况并非如此。Aokage 等通过对 453 例含有 GGO 成分的临床Ⅰ期肺腺癌患者及其腺癌亚型进行研究发现,约 40% 的患者病理结果为非贴壁亚型为主的肺腺癌。Fu 等报道,在表现为纯 GGO 的浸润性肺腺癌中,55% 为贴壁亚型为主的肺腺癌,45% 为非贴壁亚型为主的肺腺癌。因此,非贴壁为主的肺腺癌在影像学上也能够表现为纯 GGO。
浸润性肺腺癌的预后显著差于原位腺癌和微浸润腺癌,所以有些研究探索了 GGO 型肺癌病理浸润程度的预测因素。在表现为纯 GGO 的肺腺癌中,16%~27% 经病理证实为浸润性腺癌。鉴于实性结节中浸润性肺腺癌的比例远大于纯 GGO,有些研究者认为在纯 GGO 中,代表结节密度的 CT 值可能与病理浸润程度相关。然而,Fu 等纳入了 432 例纯 GGO 肺腺癌患者,发现 CT 值与病理浸润程度无关,与其相关的影像学特征仅有结节的大小。
三、GGO 的自然病程及其随访策略
NELSON 研究表明,大约 63% 的 GGO 经过 3 个月的随访后消失;在 ELCAP 研究中,66% 的纯 GGO 和 37% 的混合 GGO 最终被证实为良性。病理上认为,随访过程中缩小或消失的 GGO 为炎症或者良性结节(图1)。因此,对于新发的 GGO 病灶,不建议马上进行外科干预,而必须进行一段时间的随访,以确定其是否持续存在。
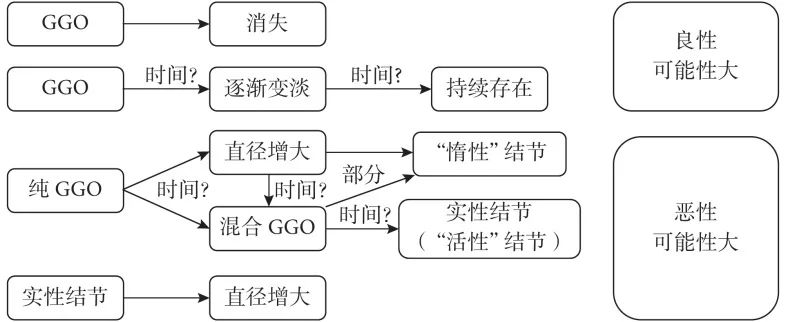
图1 磨玻璃结节(GGO)的自然病程
部分 GGO 在随访过程中进展,可表现为结节增大,也可表现为实性成分增加(图1)。Kakinuma 等发表的一项多中心前瞻性研究表明,< 1 cm 的纯 GGO 在 5 年内增大的概率为 11%,> 1 cm 的纯 GGO 则为 54%;而< 1 cm 的混合 GGO 在 5 年内增大的概率为 30%,> 1 cm 的混合 GGO 则为 87%。
另一项针对小于 5 mm 纯 GGO 的研究表明,在平均 5 年的随访时间中,约 10% 的患者出现了 GGO 的进展。对于稳定存在 5 年没有出现进展的 GGO 中,研究者又持续随访了 5 年,结果显示其增长比例为 13%。de Margerie-Mellon 等分析了来自 74 个 GGO 的 339 个时间点数据,结果表明,GGO 的体积增长遵循指数模型。研究表明,初始结节大小、男性、吸烟史、年龄和既往肺癌病史均是 GGO 增长的预测因素。有学者认为,可以通过建立 GGO 增长的预测模型指导临床实践,但是目前临床上仍无可靠的方法对 GGO 的进展进行预测。
持续存在的 GGO 往往预示着恶性病变。Cho对 39 例没有出现进展但持续存在的纯 GGO 患者进行手术,结果发现 1 例为浸润性腺癌,1 例为微浸润腺癌,21 例为原位腺癌,13 例为不典型腺瘤样增生,仅有 3 例(8%)为良性病变。若将不典型腺瘤样增生视为肺癌的癌前病变,则超过 90% 持续存在的 GGO 是与肺癌相关的病变。Ye 等报道,持续存在的 GGO 中 92.6% 最终证实为恶性。
目前,不同指南对于 GGO 的随访策略有着少许区别。GGO 随访策略的制定需要根据是否初次发现、GGO 的影像学分类以及结节大小等因素来决定。我们推荐对暂不进行手术治疗的患者采取如下的随访策略(表1)。
表1 GGO 的随访策略
*具体的随访计划应咨询临床医生
四、GGO 的外科治疗
1、GGO 的手术时机
对于影像学高度怀疑浸润性肺腺癌的 GGO,以及随访过程中直径增大或者实性成分增多的 GGO,积极的外科治疗是必要的。但是,何时进行外科介入,目前还没有定论。原位腺癌和微浸润腺癌患者接受手术切除后,5 年总生存率达到或接近 100%,而一旦进展至Ⅰ期肺癌,其 5 年总生存率则降至 73%~90%,后续生存率随着分期的增加而逐渐下降(图2)。Fu 等研究发现,> 1 cm 的纯 GGO 病理为浸润性肺腺癌的几率显著升高。因此,病理学的 AIS、MIA 和贴壁亚型为主的浸润性腺癌阶段、影像学表现为< 3 cm 的纯 GGO 和异质性 GGO,是外科手术介入的最佳时机,患者能够获得最佳的治疗效果。
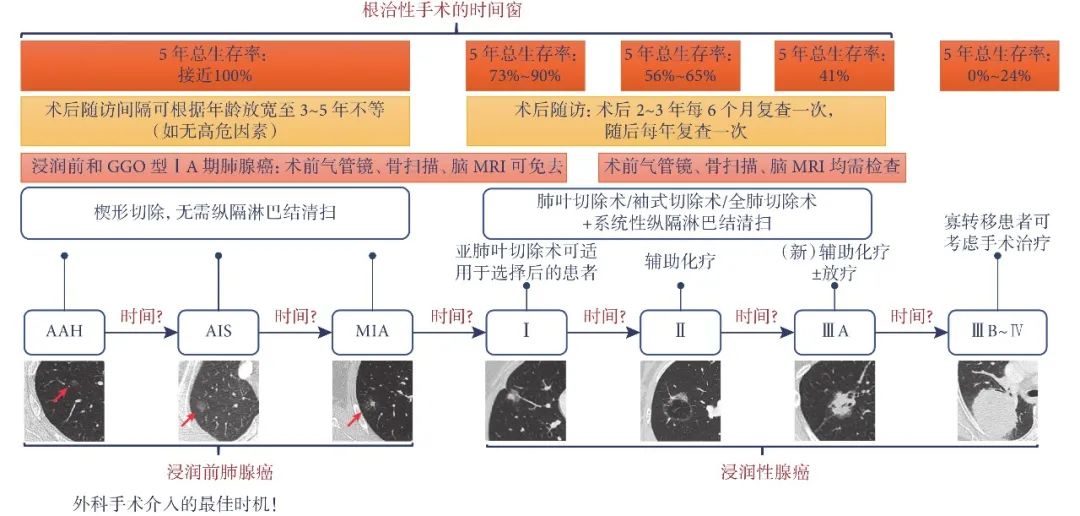
图2 肺腺癌的外科治疗及预后
AAH:不典型腺瘤样增生;AIS:原位腺癌;GGO:磨玻璃结节;MIA:微浸润腺癌;MRI:磁共振检查
2、GGO 型肺癌的术前检查
GGO 型肺癌(特别是纯 GGO)的术前检查已经被简化。由于 GGO 型肺癌一般处于疾病的早期阶段,远处转移的发生率很低。回顾性研究表明早期肺癌患者不一定需要做脑部磁共振、骨扫描和气管镜检查。前瞻性研究也表明,术前骨扫描和支气管镜检查对于 GGO 型肺癌患者没有获益,因此他们术前不需要进行骨扫描和支气管镜检查。
3、GGO 型肺癌的手术方式
GGO 型肺癌的最佳手术方式为大部分研究者所关注。1995 年,Ginsberg等针对局部切除术和肺叶切除术的前瞻性随机对照试验(randomized clinical trial,RCT)奠定了肺叶切除术在肺癌根治术中的地位。随着 LDCT 的普及,肺癌的疾病谱发生了巨大变化,越来越来越多 GGO 型肺腺癌被发现,肺叶切除可能并不适用于周围型 GGO 肺癌患者。
术中冰冻病理检查能够用于指导 GGO 的手术方式。Liu 等研究了 803 例临床Ⅰ期的周围型肺腺癌患者,发现术中冰冻病理诊断原位腺癌/微浸润腺癌与术后石蜡病理的一致率达到 96.1%。对于术中冰冻病理诊断为原位腺癌/微浸润腺癌的患者仅行亚肺叶切除,不清扫纵隔淋巴结,其 5 年无复发生存率达 100%。术中冰冻指导亚肺叶切除的手术治疗策略,是国际上早期肺癌个体化外科治疗的重大进步。即使如此,仍有小部分患者术中被诊断为不典型腺瘤样增生/原位腺癌/微浸润腺癌而术后石蜡病理诊断为浸润性腺癌。Zhang 等对这部分患者展开研究,结果表明,对于术中冰冻“低估”的肺癌患者,其术后 5 年无复发生存率仍为 100%。
结节大小和实性成分比例(consolidation-to-tumor ratio,CTR)是也能用于确定肺癌的手术方式。CTR 的定义为肺窗上实性成分最大径与结节最大径的比值,是衡量 GGO 中实性部分占比的指标。日本临床肿瘤研究组(JCOG)一项多中心研究(JCOG0201)发现,如果将直径≤ 3 cm 并且 CTR ≤ 0.5 的病灶定义为影像学上非浸润,那么这组患者的 5 年总体生存率为 96.7%。另一个临床试验(JCOG0804)则探究了亚肺叶切除术在直径≤ 2 cm 并且 CTR ≤ 0.25 的病灶中的应用,这组患者的 5 年无复发生存率达到 99.7%。然而,对于 CTR > 0.5 的肺结节,手术方式目前还无定论,需要进一步的高级别循证医学证据来确认其最佳手术方式。
目前,针对此问题有两项正在进行的 RCT,它们分别是日本的 JCOG0802 和美国的 CALGB140503。JCOG0802 纳入了直径不大于 2 cm 并且 CTR 为 0.5~1.0 之间的混合 GGO 和实性结节,CALGB140503 则纳入了除纯 GGO 外直径≤ 2 cm 的肺结节。2021 年 AATS 年会上,JCOG0802 公布了部分研究结果。结果显示,肺段切除在总体生存率和肺功能方面显著优于肺叶切除,提示对于直径≤ 2 cm 而且 CTR > 0.5 的周围型非小细胞肺癌,肺段切除应成为标准治疗方式,不过这需要未来更多的研究去证实。
系统性纵隔淋巴结清扫一直被认为是肺癌根治性手术的重要一环,然而这一观点在 GGO 型肺癌患者中受到了挑战。Zhang 等发现,CTR 介于 0 到 0.5 的 GGO 无淋巴结转移。Hattori 等对 462 例混合 GGO 患者进行倾向性评分匹配,发现 GGO 型肺癌的淋巴结清扫程度与患者的预后无关。此外,由于原位、微浸润和贴壁亚型为主型的腺癌患者不发生淋巴结转移,因此术中冰冻病理对淋巴结清扫也具一定指导作用。基于以上研究,GGO 型肺癌患者可能无需系统性纵隔淋巴结清扫,但这仍需要临床试验的进一步验证,目前相关的前瞻性研究正在进行中(NCT04527419)。
4、GGO 型肺癌的术后随访
GGO 型肺癌患者的术后随访流程也应该被简化。2019 年发布的 ASCO 指南指出,接受根治性治疗的肺癌患者应该在术后2年内每 6 个月接受 1 次术后随访检查,在2年后每年接受 1 次术后随访检查。对于原位腺癌和微浸润腺癌以及纯 GGO 的浸润性肺腺癌患者,考虑到其 5 年无复发生存率接近 100% ,他们可能在术后 3~5 年内不需要术后随访复查。
5、GGO 型肺癌的手术策略
针对 GGO 的手术策略还需综合考虑多种因素。
第一,GGO 是否需行手术治疗应结合患者的预期寿命。对于老年合并其它基础疾病的 GGO 患者,如果他们的预期寿命短于 GGO 的进展时间,建议随访即可。对于年轻的 GGO 患者,他们具有很长的预期寿命,因此我们推荐在不需切除过多肺组织的时候选择合适的时间点进行手术治疗;
第二,需结合 GGO 的具体位置,对于亚肺叶切除能够根治的周围型 GGO,可以采取积极手术干预;对于因结节位置较深而必须行肺叶切除的 GGO,则建议在安全期内随访,延长高质量生活的时间。由于两肺下叶在肺通气与换气中占主要地位,因此对于发生在下叶的 GGO,应更积极地在能够行亚肺叶切除的阶段进行手术干预,以避免 GGO 进展后必须行肺下叶切除,从而达到保留更多有效肺组织的目的;
第三,合理选择 GGO 型肺癌的手术时机。GGO 型肺癌进展缓慢,外科处理窗口期长,因此手术时机的选择应以不影响人生轨迹和职业生涯为原则。除此之外,患者的心理因素也是决定 GGO 型肺癌手术时机的因素。部分患者可能由于存在 GGO 而患上焦虑症,影响生活质量,对于这种患者择期手术或许是较为合适的治疗方法。
五、GGO 型肺癌的预后
许多既往的研究表明,GGO 型肺癌与良好的预后显著相关。Fu 等发现在浸润性Ⅰ期非小细胞肺癌中,纯 GGO、混合 GGO 和实性结节的 5 年无复发生存率分别为 100%、87.6% 和 73.2%。Hattori 等道了影像学上表现为 GGO 和实性的临床ⅠA 期肺腺癌,5 年总体生存率分别为 91.2% 和 68.9%。对于影像学上表现为异质性 GGO 的肺癌患者,其生存率与纯 GGO 相似,术后5年无复发生存率达 100%。对于影像学上直径> 3 cm 的 GGO,即使与实性结节组进行实性成分大小的倾向性评分匹配,GGO 组仍具有较好的预后。GGO 与实性结节之间不仅生存率存在差异,而且组内预后因素也不同。
根据第 8 版肺癌 TNM 分期,在≤ 3 cm 的结节中,其临床 T 分期主要基于实性成分大小。纯 GGO 被定义为 cTis,0~0.5 cm、0.6~1.0 cm、1.1~2.0 cm 和 2.1~3.0 cm 实性成分的混合 GGO 分别被定义为 cT1mi、cT1a、cT1b 和 cT1c。Kim 等回顾性研究了 744 例临床ⅠA 期肺腺癌患者,结果发现 GGO 预示着良好的生存(P=0.016)。进一步的研究发现,如果将 GGO 成分和临床 T 分期同时纳入 Cox 比例风险模型中时,GGO 成分便不再有预后意义(GGO 成分,P=0.291;cT 分期,以 cT1mi/cT1a 为对照,T1b:P=0.033,cT1c:P<0.001)。因此,该研究认为第 8 版 TNM 分期对混合 GGO 是足够的。然而,Ye 等的研究纳入了来自 911 位肺腺癌患者的 988 个结节,发现混合 GGO 的实性成分大小或总大小对患者的预后并无影响。Hattori 等的研究也得出了类似的结论。因此,有作者认为混合 GGO 应该被归为同一类特殊亚型,而不是依据目前 TNM 分期来分类。上述结论不一致的原因可能是混合 GGO 患者总体上具有良好预后。如果想要研究这类患者的预后因素,大样本和长时间随访是必不可少的。关于混合 GGO 中实性成分大小和总肿瘤大小是否具有预后作用目前还无定论,还需要进一步的研究来阐明。
脏层胸膜浸润不是混合 GGO 的预后因素。传统观点认为,脏层胸膜浸润与非小细胞肺癌患者的不良预后密切相关,并被纳入肺癌的第 8 版 TNM 分期中。然而,Hattori 等研究了 466 例直径< 3 cm 的 pN0 非小细胞肺癌患者,结果发现在混合 GGO 中,脏层胸膜浸润不具有预后意义(P=0.191)。在 Fu 等的研究中,脏层胸膜浸润也不是混合 GGO 的预后因素(P=0.514)。
六、多发 GGO 的处理
3.7%~8.0% 的肺癌患者表现为多发肺结节,该比例在 GGO 型肺癌中更高,而多发肺结节可能为多原发或者肺内转移。1975 年,Martini 和 Melamed首次提出了多发肺结节的鉴别标准,认为具有不同组织学类型的多发肺结节应定义为多原发,具有相同组织学类型但结节位于不同淋巴引流区域的不同肺段、肺叶及对侧肺的多发肺结节也应定义为多原发。2014 年,Zhang 等提出了基于组织学和基因突变的判断标准,也提出要根据多原发肿瘤中最大肿瘤的直径进行 T 分期。2016 年,国际肺癌研究学会提出,对于多发 GGO 或者贴壁亚型肿瘤,最终的 T 分期应该由其结节中最高的 T 分期来决定,而且这些结节应该被视为多原发。2020 年,Zhang 等的研究表明多发 GGO 或者一个实性结节加一个或多个 GGO 也应被视为多原发。
目前针对多发 GGO 的治疗策略仍无定论。相比于单发 GGO,对多发 GGO 的治疗需要更周到的考虑。对于无法完全切除的多发 GGO,建议先进行随访,对随访过程中进展的 GGO 进行外科切除。对于能够完全切除的多发 GGO,Zhang 等提出,怀疑为恶性的混合 GGO、同侧易于切除的纯 GGO 以及对侧肿瘤直径变大或实性成分变多的 GGO 均应接受手术切除,同侧的多发 GGO 尽量通过单次手术进行切除。GGO 的手术切除需以主病灶优先,同时兼顾次要病灶。手术方案的选择应该基于肿瘤直径、位置、CT 表现、患者体力评分和心肺功能等,在肿瘤根治的前提下尽可能多地保留肺实质。术前定位可帮助术者确定多发 GGO 的具体位置,减小手术切除范围。另外,化疗、靶向治疗和免疫治疗作为晚期肺癌的治疗手段,不建议在多发 GGO 中采用。冷热消融并非是一种根治性的肿瘤治疗手段,笔者建议慎重对多发 GGO 采用冷热消融治疗。多发 GGO 的外科切除适应证及术式选择目前还没有共识,多发 GGO 的最佳处理策略还需要更多的证据。
七、GGO 与肺癌低危人群筛查
在过去的 20 年间,基于 LDCT 的肺癌筛查试验显著降低了人群的肺癌相关死亡率。美国的 NLST 肺癌筛查试验表明,与胸部 X 线片相比,使用 LDCT 进行筛查能够降低 20% 的肺癌相关死亡率。欧洲 NELSON 试验表明,与对照组相比,LDCT 能够使得男性 8 年肺癌死亡率降低 24%,女性 8 年肺癌死亡率降低 59%。然而,NLST 和 NELSON 纳入的参与者均为肺癌的高危患者(高龄、吸烟),因此多数指南均推荐对高危人群进行一年一次的 LDCT 肺癌筛查。研究表明,在美国大约半数的肺癌患者不满足 NLST 的标准,每年一次 LDCT 的筛查频率也缺乏确切的生物学依据。近年来,一项基于中国人群的研究表明,肺癌在女性中的检出率显著高于男性(2.5% vs. 1.3%, P=0.001),在非吸烟者中的检出率高于吸烟者(2.2% vs. 1.4%)。值得注意的是,在筛查发现的肺癌中,95.5% 的患者在影像学上表现为 GGO。因此,传统上被认为是“肺癌低危人群”的年轻非吸烟女性实际上面临着较大罹患 GGO 型肺癌的风险。
因此,我们提出以下基于危险因素的“低龄、低频”肺癌筛查策略(图3)。较早的初始筛查年龄有助于达到早期检出早期肺癌的目的,而较长间隔的 LDCT 随访策略能够在降低 CT 辐射剂量。由于 LDCT 筛查中 GGO 型肺癌多见,延长随访间隔造成肿瘤进展可能性小,而在较长随访间隔中出现的新发 GGO 很大程度上也是可以治愈的,不影响患者的生存率。我们建议,第一次肺癌筛查的时间可以提早到 30 岁,因其它原因(如肺炎、新冠肺部影像学筛查)而行的胸部 CT 检查也可当作肺癌筛查;对于< 50 岁的人群,如果初始 CT 是阴性的,筛查间隔可以设置为 5~10 年;对于年龄 50~60 岁人群,根据是否存在高危因素(除年龄外),筛查间隔可以为 3~5 年;对于年龄 60~< 70 岁人群,根据是否存在高危因素(除年龄外),筛查间隔可以为 2~3 年;对于≥ 70 岁的人群,筛查间隔为 2 年。
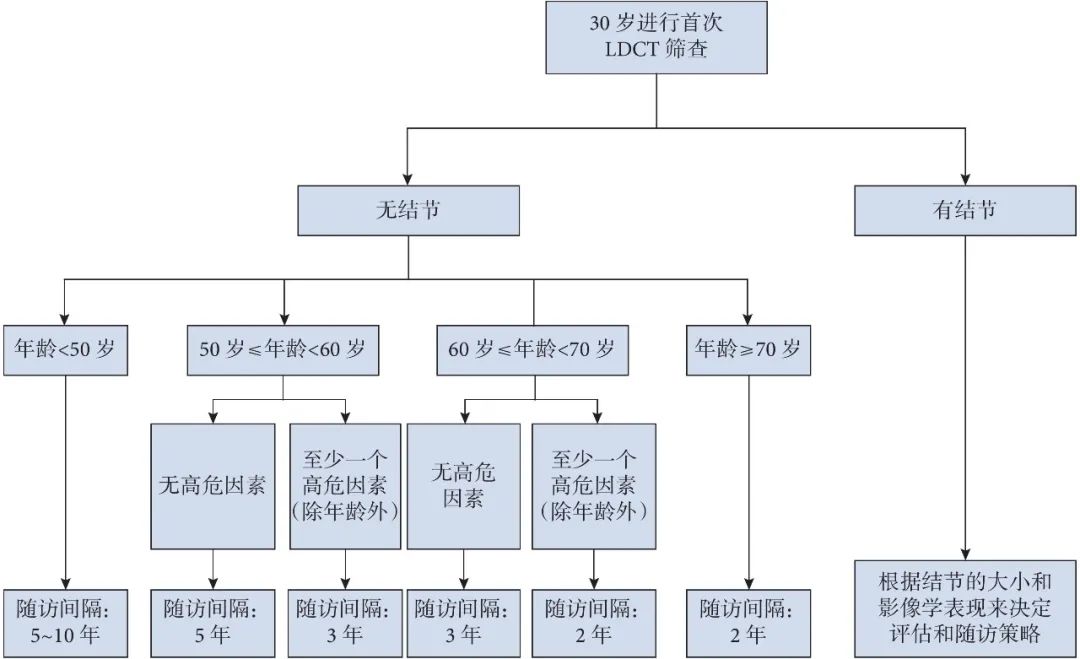
图3 基于高危因素的“低龄低频”肺癌筛查策略
八、GGO 的过度诊断和过度治疗
有学者认为,GGO 型肺癌是一种惰性的肿瘤,不应在 GGO 发现早期对其进行手术干预,以避免过度诊断与过度治疗。目前,对于 GGO 的过度诊断与过度治疗尚无明确定义,可以认为,若筛查发现的肺癌不经治疗也不会影响患者的寿命,则对其行手术切除可能会构成过度诊断与过度治疗。在此,笔者总结下述的要点,以帮助临床医生最大程度减少 GGO 的过度诊断与过度治疗。
第一,避免将良性病变当作恶性肿瘤治疗。GGO 病变可能是良性的,也可能是恶性的,4~6 个月的随访即可对结节的良恶性进行有效的鉴别。随访一段时间后持续存在的 GGO,可以考虑行手术治疗。应用该策略,Ye 等[32]证实 92.6% 持续存在的 GGO 病理为恶性。
第二,避免将浸润前或微浸润病变当作浸润性病变来治疗,避免将惰性病变当作恶性程度高的病变来治疗。对于部分 GGO 型肺癌,亚肺叶切除以及选择性纵隔淋巴结清扫或采样可能已经足够,而肺叶切除和纵隔淋巴结清扫即可能构成“过度治疗”。相比于肺叶切除,亚肺叶切除能够给患者保留更多的肺实质,让患者术后拥有更好的生活质量。
第三,综合判断随访和手术的优缺点。虽然手术可能会导致手术相关的并发症和肺功能的下降,但是亚肺叶切除术对患者肺功能的影响相对较小,患者也能较快从手术中恢复。与此同时,LDCT 的副作用也不应该被我们忽视。Fleischner 学会建议,对持续存在的 GGO 每 1~2 年需进行 1 次 CT 随访。Bach 等[80]通过对 NLST 的数据研究发现,每 2 500 人接受 LDCT 筛查,大约会有一人因辐射引发的癌症死亡。病理证实为 AIS 和 MIA 的患者术后不会发生复发,他们在术后 3~5 年内不需要进行 CT 随访,降低辐射暴露风险。
九、展望
基于上述大量研究,我们对 GGO 型肺癌的认识已经取得了长足的进步,然而仍有许多问题亟待解答,笔者在此提出以下两点:
第一,GGO 型肺癌的病因仍不明确。传统观点认为,长期吸烟和肺癌存在较大的联系。然而,近期研究却表明,在筛查发现的肺癌中相当一部分患者为年轻、非吸烟女性,且大部分在影像学上表现为 GGO,该现象背后的原因值得深究。
第二,如何预测 GGO 型肺癌的进展速度?已有研究尝试通过患者临床基本特征、影像组学、基因组学等方法进行预测,但目前尚无可靠模型对该问题进行解答。此外,GGO 进展过程中的分子事件也需要进一步的探究。尽管目前 GGO 型肺癌的临床诊治仍存在一些争议,但我们正朝着 GGO 型肺癌个体化规范治疗的目标前进。
